Duanana teh sanyawa kimia sabab unsur kimia diwangun ku molekul, sareng ieu dina gilirannana diwangun ku atom. Atom tetep ngahiji berkat dibentukna anu disebut tautan kimia.
The beungkeut kimia henteu sadayana sami: dasarna aranjeunna gumantung kana ciri éléktronik tina atom-atom anu aya. Aya dua jinis tautan anu paling umum: beungkeut ionik jeung beungkeut kovalén.
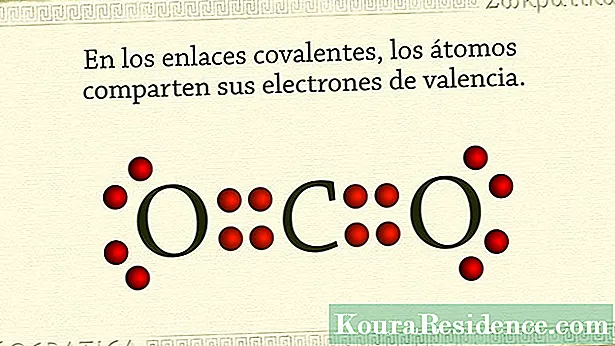
Ilaharna, beungkeut kovalén nyaéta anu tahan atom sanés logam. Éta kajadian yén atom unsur ieu ngagaduhan seueur éléktron dina cangkang na paling luar sareng gaduh kacenderungan pikeun nahan atanapi kéngingkeun éléktron, tibatan nyerah.
Éta sababna cara kumaha zat ieu atanapi sanyawa kimiaicos ngahontal stabilitas nyaéta ku ngabagi sapasang éléktron, usanés tina unggal atom. Ku cara kieu pasangan éléktron anu dibagi umum pikeun dua atom sareng dina waktos anu sami nahan aranjeunna. Dina gas bangsawan, contona, ieu kajadian. Ogé dina unsur halogén.
Nalika ikatan kovalén lumangsung antara unsur éléktronégativitas anu sami, sapertos antara hidrogén sareng karbon, hiji beungkeut dihasilkeun kovalén apolar. Ieu kajadian, contona, dina hidrokarbon.
Kitu ogé, molekul homonuklear (diwangun ku atom anu sami) salawasna ngabentuk beungkeut apolar. Tapi upami beungkeutna aya di antara unsur éléktronegativitas anu béda, kapadetan éléktron anu langkung luhur dihasilkeun dina hiji atom tibatan anu sanés, salaku hasil tina ieu tiang kabentuk.
Kamungkinan katilu nyaéta dua atom ngabagi sapasang éléktron, tapi éléktron dibagi ieu ngan ukur disumbang ku hiji atom. Dina hal éta urang nyarioskeun datif atanapi koordinat beungkeut kovalén.
Pikeun a tautan dative anjeun peryogi unsur anu nganggo pasangan éléktron gratis (sapertos nitrogén) sareng unsur anu sanésna éléktron (sapertos hidrogén). Perlu ogé yén anu ngagaduhan pasangan éléktronik cukup éléktronegatif pikeun henteu éléh éléktron pikeun dibagi. Kaayaan ieu lumangsung, contona, dina amonia (NH4+).
The zat ngandung sanyawa kovalén tiasa lumangsung dina kaayaan zat (padet, cair atanapi gas), sareng sacara umum aranjeunna konduktor goréng tina panas sareng listrik.
Aranjeunna sering nunjukkeun lebur sareng titik golak anu relatif handap jeung biasana leyur dina pelarut polar, sapertos bénzéna atanapi karbon tetrachloride, tapi ngagaduhan kaleyuran lemah dina cai. Aranjeunna stabil pisan.
Seueur conto sanyawa atanapi zat anu ngandung ikatan kovalén tiasa dipasihkeun:
- Fluorin
- Bromin
- Iodin
- Klorin
- Oksigén
- Cai
- Karbon dioksida
- Amonia
- Metana
- Propana
- Silika
- Intan
- Grafit
- Kuarsa
- Glukosa
- Parafin
- Diesel
- Nitrogén
- Hélium
- Freon


